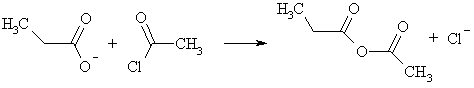
Карбоновые кислоты
Свойства карбоновых кислот
Кислотность
На степень диссоциации кислот большое влияние оказывает полярность растворителя. Максимальная степень диссоциации наблюдается в воде: рКа муравьиной кислотысоставляет 3.75, уксусной - 4.8. Для замещенных жирных карбоновых кислот степень диссоциации сильно зависит от электронного эффекта заместителя при α-углеродном атоме, электронокцепторные заместители повышают кислотность.
Кислота рКа
CH3COOH 4.8
ClCH2COOH 2.9
Cl2CHCOOH 1.3
CCl3COOH 0.7
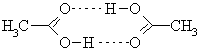
Кислоты в большей степени, чем спирты, образуют водородные связи, т.к. их молекулы более полярны и имеют карбонильный кислород, который является более основным, чем спиртовый гидроксил. Поэтому кислоты имеют более высокие температуры кипения, чем соединения других классов, имеющие такую же молекулярную массу. Например, температура кипения масляной кислоты и амилового спирта, имеющих молекулярную массу 88, составляет соответственно 162 и 138 °С. В разбавленных растворах в неполярных средах и в газовой фазе карбоновые кислоты существуют в виде димеров.

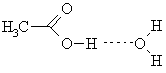
Межмолекулярные водородные связи образуются между кислотами и водой, либо другими соединениями, имеющими неподеленные пары электронов и кислые протоны: вода, спирты. Поэтому безводная уксусная кислота, известная также по названием «ледяная», используется как водоотнимающий реагент средней силы.
Замещение водорода в карбоксиле: кислотность и реакции по кислороду
Карбоновые кислоты образуют соли, реагируя с металлами, их оксидами и гидроксидами, аммиаком и аминами, вытесняют более слабые кислоты из солей.
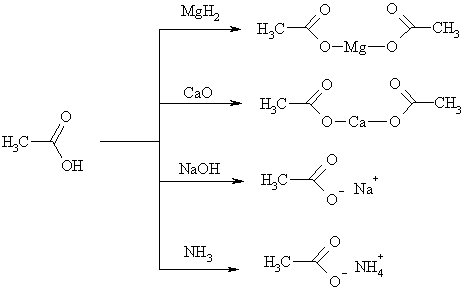
Карбоновые кислоты реагируют с карбонатами металлов (почти все они сильнее, чем H2CO3), реактивами Гриньяра, ацетиленидами и гидридами металлов. В результате всех этих обменных реакций образуются соли кислот, имеющие общее название карбоксилаты и собственные названия, соответствующие названию аниона кислоты: формиаты, пропионаты, бутираты, бензоаты. Натриевые и калиевые соли высших жирных кислот называются мылами, т.к. являются поверхностно-активными веществами.
Анионы карбоновых кислот участвуют в реакциях нуклеофильного замещения, выступая в качестве нуклеофилов. Так, с галогеналканами они образуют сложные эфиры.
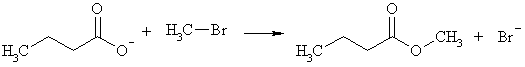
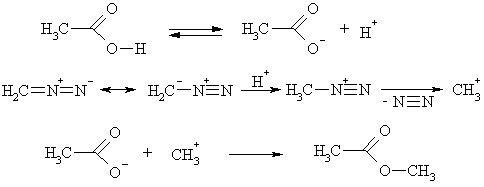
Низшие кислоты, обладающие сравнительно высокой кислотностью, превращаются при действии на них диазометаном в метиловые эфиры. В этом превращении протон кислоты сначала переходит к атому углерода молекулы диазометана, т.е. последний реагирует как основание. Образующийся неустойчивый катион метилдиазония распадается с выделением N2, вследствие чего возникает метилениевый ион, который и соединяется с анионом кислоты.
Взаимодействие солей карбоновых кислот с ацилгалогенидами приводит к образованию ангидридов кислот. Таким способом могут быть получены смешанные ангидриды.