Карбоновые кислоты
Свойства карбоновых кислот
Основность. Замещение гидроксила
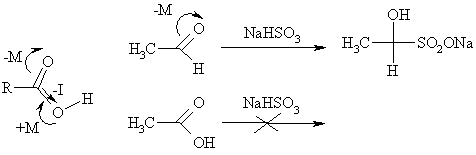
В молекулах карбоновых кислот возможно замещение гидроксильной группы, что используется для получения различных функциональных производных. Превращение протекает при действии нуклеофилов. Однако, большинство сильных нуклеофилов являются основаниями, поэтому они в первую очередь депротонируют карбоксильную группу, т.е. превращают кислоту в анион. В карбоксилат-ионе атом углерода не обладает необходимым дефицитом электронной плотности, и реакция останавливается. Применение более слабых нуклеофилов также не приводит к положительным результатам, так как электрофильность карбоксильного углерода кислоты меньше, чем в оксосоединениях, т.к. она погашается +М-эффектом гидросильного кислорода. К примеру, слабый нуклеофил – гидросульфит натрия – к карбоксильной группе не присоединяется.

Поэтому для нуклеофильного замещения гидроксильной группы (реакции ацилирования) подбирают специальные условия. Так, реакцию кислот со спиртами для получения сложных эфиров (этерификация кислот) проводят в присутствии серной кислоты или газообразного хлороводорода, которые выполняют роль катализаторов. Катализ заключается в протонировании карбонильного атома кислорода на первой стадии, что повышает эффективный положительный заряд на углероде и облегчает атаку нуклеофила. На одной из последующих стадий происходит протонирование уже гидроксила и превращение его в хорошую уходящую группу – молекулу H2O.
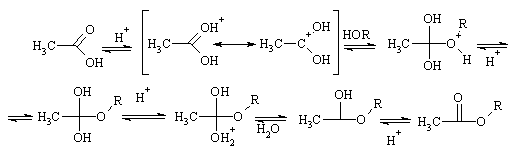
Все стадии реакции этерификации обратимы, поэтому для получения сложного эфира с хорошим выходом необходимо удалять выделяющуюся воду. В классическом варианте синтеза для связывания воды используется та же серная кислота; в других случаях применяют избыток нуклеофила (спирта).
Очевидно, что реакция, если рассматривать ее с другой стороны, протекает как замещение в молекуле спирта атома водорода на ацил, поэтому превращение называют ацилированием спирта. Оно относится к большому классу реакций, которые объединены общим названием «реакции ацилирования».
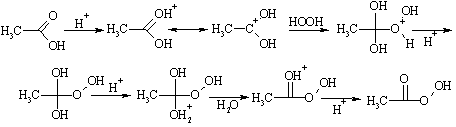
По аналогичному механизму протекает взаимодействие карбоновых кислот с пероксидом водорода в кислой среде. В результате этой реакции получаются так называемые надкислоты, имеющие важное значение для органического синтеза: они используются в качестве источников свободных радикалов и окислителей.
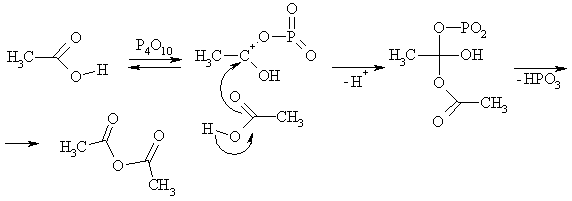
В рассмотренных примерах гидроксил путем протонирования превращается в хорошую уходящую группу – молекулу воды, а на первой стадии имеет место активация электрофильного центра кислотой. Аналогично, ацилирование катализируется кислотами Льюиса. Так, при действии на кислоты пентахлорида фосфора или тионилхлорида происходит замещение гидроксильной группы хлором и образуются хлорангидриды кислот. В ходе превращения протон замещается на сильный акцептор электронов, превращающий гидроксил в хорошую уходящую группу.
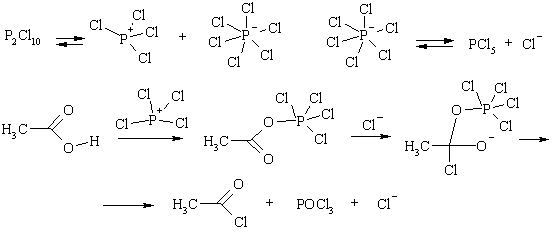
Однако нужно иметь в виду, что атомы кислорода в этих реакциях меняются местами, т.е. фактически замещается не гидроксильный, а карбонильный, т.к. именно к нему присоединяется кислота Льюиса на первой стадии. Аналогично, превращение кислот в ангидриды при действии пентаоксидом фосфора идет через стадию замещены карбонила на хорошую уходящую группу.
Гидроксил не удается заместить аминогруппой при действии аммиака или аминов на кислоту в мягких условиях. Указанные реагенты являются более сильными основаниями, чем карбонильная группа. Поэтому катализ кислотами, как в реакции этерификации, или замена протона сильным электроноакцептором, как при образовании ацилгалогенидов и ангидридов, в этом случае невозможны. Аммиак и амины образуют соли с карбоновыми кислотами, а карбоксилат-ион электрофилом не является. Тем не менее, при высокой температуре карбоксилаты аммония превращаются в амиды. Это объясняется тем, что соль диссоциирует при нагревании на кислоту и аммиак (амин), который как нуклеофил атакует карбоксильный атом углерода, но процесс этот требует жестких условий.
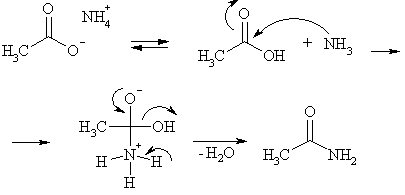
Можно сказать, что данная реакция идет благодаря термодинамическому фактору: возрастание энтальпии за счет образования стабильного амида и возрастание энтропии за счет образования газообразной в этих условиях воды.