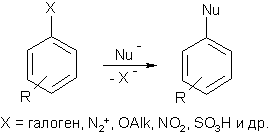
Нуклеофильное замещение в ароматическом кольце
Реакции нуклеофильного ароматического замещения можно описать общей схемой:
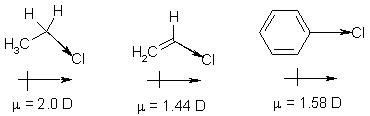
Наиболее часто в подобных реакциях в качестве субстратов используют галогенарены. Главными факторами, влияющими на реакционную способность арилгалогенидов, являются порядок и полярность связи углерод-галоген. Как известно, количественно полярность связи может быть охарактеризована величиной дипольного момента, наличие которого обусловлено разницей электроотрицательностей углерода и галогена. Электронная плотность σ-связи смещена к галогену (-I-эффект), причем этот эффект выражен тем ярче, чем больше электроотрицательность галогена, т.е. полярность возрастает в ряду I – Br – Cl – F. Выше мы говорили, что дипольные моменты молекул галогеналканов колеблются в пределах 1,8-2,0 D. В молекулах ароматических галогенидов, равно как и других соединений, имеющих галоген при sp2-гибридном углероде величина дипольного момента ощутимо меньше и составляет 1.5 – 1.8 D. Это связано с тем, что галоген, наряду с -I-эффектом, проявляет еще и +М-эффект вследствие сопряжения одной из неподеленных электронных пар с π-электронной системой.
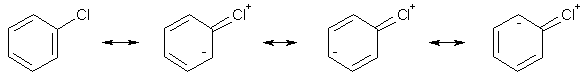
Интересно, что +M-эффект атомов галогенов нарастает в том же ряду, что и их –I-эффект, т.к. сопряжение тем эффективнее, чем ближе по энергии лежат орбитали углерода и гетероатома. Таким образом, фтор является одновременно самым сильным σ-акцептором и самым сильным π-донором среди галогенов.
Вышеуказанные электронные эффекты определяют основные химические свойства арилгалогенидов.