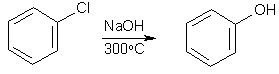
Нуклеофильное замещение в ароматическом кольце
Механизмы нуклеофильного ароматического замещения
Механизм отщепления-присоединения (Е-А)
Нуклеофильное замещение галогена при sp2-гибридном атоме углерода протекает несравненно труднее, чем при sp3-гибридном. Так, галогенбензолы, в отличие от галогеналканов, гидролизуются под действием щелочей лишь при температуре 200 оС и выше. Поэтому реакция имеет не столько синтетическое, сколько теоретическое значение.
Это явление связано с тем, что положительный мезомерный эффект галогена обусловливает значительное упрочнение его связи с углеродным атомом ароматического кольца. Кроме того, на атоме углерода низок дефицит электронной плотности, который является необходимым условием для атаки нуклеофилом, поэтому реакции типа SN2 и SN1 оказываются невозможными. Ароматическое нуклеофильное замещение протекает по принципиально другим механизмам.
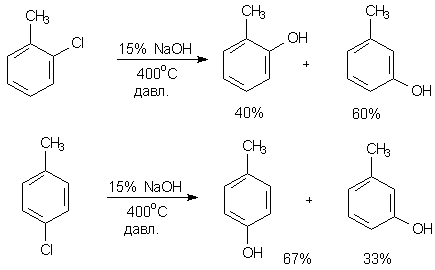
Было обнаружено, что неактивированные электроноакцепторными заместителями галогенароматические соединения дают при действии сильных нуклеофилов и в жестких условиях смесь двух изомерных продуктов замещения галогена. Например, так протекает гидролиз хлортолуолов.
Аналогичная картина наблюдается при аминодегалогенировании о-хлортолуола действием амида калия – сильнейшего нуклеофила и основания одновременно.
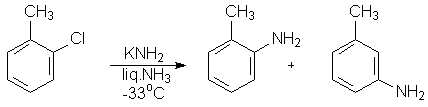
Интересно, что реакция возможна лишь в тех случаях, когда хотя бы одно орто-положение относительно атома галогена не занято.
Объяснить все эти факты можно только тем, что на первой стадии превращения сильный нуклеофил выступает в качестве основания и отрывает протон от субстрата. Наиболее легко протон отрывается от орто-С-атома, который является наиболее «кислым» благодаря σ-акцепторным свойствам галогена. Образовавшийся нестабильный σ-анион легко теряет галогенид-ион и превращается в циклогексадиенин – дегидробензол или бензин. Последний в результате присоединения нуклеофила и последующего протонирования дает продукт замещения. Этот путь реакции называеется ариновым механизмом нуклеофильного замещения, или реакция ароматического отщепления-присоединения (E-A).
Ввиду того, что свойства атомов, связанных тройной связью, очень близки даже при наличии заместителей в других положениях ядра, региоселективность присоединения нуклеофила к арину отсутствует. Если атомы углерода эквивалентны, т.е. в незамещенном бензине, полученном из собственно хлорбензола, образуется один продукт, в противном случае – смесь изомеров. Так, меченый атомом 13С хлорбензол (химические свойства изотопов отличаются слабо) дает смесь состава 50:50.
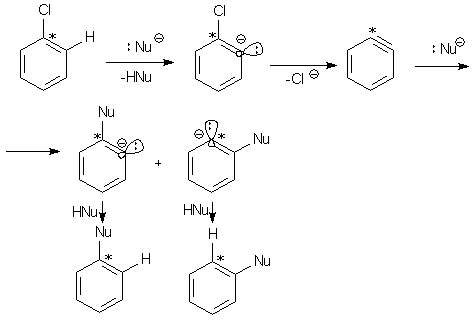
Кроме амид- и гидроксид-иона, дегидробензол присоединяет любые другие нуклеофилы. Так, относительные скорости присоединения галогенид-ионов соответствуют их нуклеофильности: I- (60) > Br- (10) > Cl- (1).
Электронное строение аринов представляется следующим образом. Одна π-связь между sp-гибридными атомами участвует в ароматическом сопряжении, тогда как другая лежит вне кольца и изолирована от ароматического секстета. Дегидробензол можно представить и в виде резонансной структуры с кумулированными двойными связями.
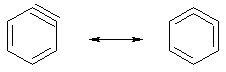
Современные исследования показывают, что кумуленовая граничная форма имеет больший вклад, чем ацетиленовая. Геометрические параметры дегидробензола приведены на рисунке.
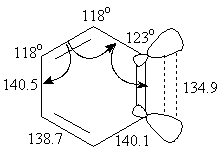
Дегидробензол является крайне нестабильным соединением, поэтому в течение длительного времени его не могли выделить. В самом деле, в правильном шестиугольнике трудно представить себе одну из связей тройной, т.к. известно, что sp-гибридный атом подразумевает линейную геометрию и стремится иметь валентный угол, равный 180°. Поэтому дегидробензол – частица с сильно напряженными валентными углами, не участвующая в сопряжении π-связь расположена вне ароматического кольца и легко доступна атаке нуклеофилов. Она активно присоединяет реагенты еще и потому, что оси орбиталей не параллельны, они удалены друг от друга и их перекрывание ослаблено.
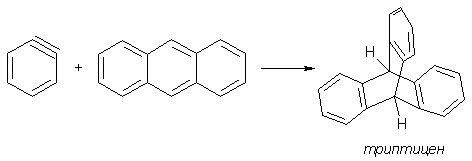
Возникновение арина в качестве интермедиата нуклеофильного замещения было доказано выделением его производных, когда в реакционную смесь добавляли соединения-«ловушки». Пространственно напряженная тройная связь является сильнейшим диенофилом, поэтому арин легко вступает в реакцию Дильса-Альдера, например, с антраценом.
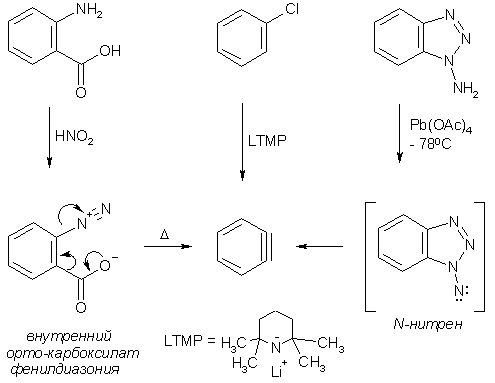
Дегидробензол образуется не только при действии оснований на галогенбензолы, но также может быть получен из других источников. Так, термическое разложение диазотированной антраниловой кислоты и окисление N-аминобензотриазола приводят к дегидробензолу, что позволило зафиксировать его в аргоновой матрице.