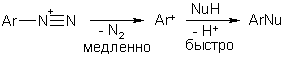
Нуклеофильное замещение в ароматическом кольце
Механизмы нуклеофильного ароматического замещения
Каталитическое нуклеофильное замещение (SNR1)
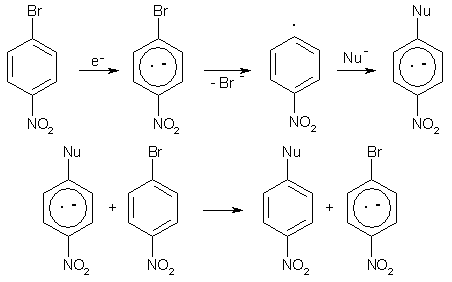
Нуклеофильное замещение облегчается в присутствии одноэлектронных восстановителей, например, металлов в нулевой или низшей степени окисления. Так, аминодегалогенирование облегчается в присутствии порошкообразной меди (реакция Ульмана). Дж. Беннет (1970) предложил, что механизм этого превращения включает стадию образования свободного арильного радикала.

В присутствии растворенного в аммиаке калия на аминогруппу заменяется даже не активированный атом галогена, причем ариновый интермедиат не образуется.
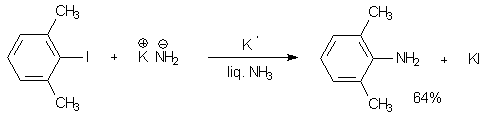
Реакции такого типа называют радикальным нуклеофильным замещением (SRN1).
Реакцию можно проводить при облучении, при этом функцию восстановителя выполняет сам нуклеофил.
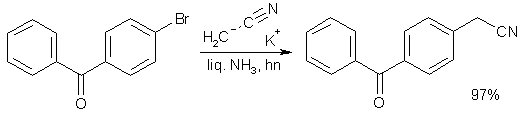
Еще более эффективным катализатором замещения галогена являются растворимые в органических жидкостях комплексные соединения тяжелых металлов в нулевой степени окисления с органическими лигандами. Так, относительно стабильный тетракис-(трифенилфосфин)палладий катализирует замещение брома или иода на самые разнообразные группы, причем реагент не обязательно должен быть сильным нуклеофилом как таковым (реакция кросс-сочетания Соногашира или Фудживары-Хека).
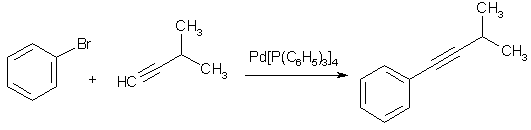
Превращение протекает в мягких условиях, и избирательно, даже при наличии в молекуле субстрата таких электроноакцепторных групп, как сложноэфирная и даже альдегидная. Это связано с тем, что образование связи С-С и разрыв связи C-Hal происходят в координационной сфере смешанного комплексного соединения, образованного атомом металла, арилгалогенида и реагента.
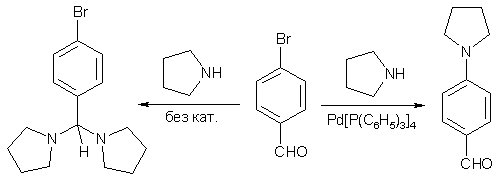
Нужно отметить, что в каталитических реакциях замещения сравнительная активность галогенов имеет обратный порядок: наибольшую реакционную способность проявляют арилиодиды, наименьшую – фториды. Это связано с тем, что вступление арилгалогенида в координационную сферу металла требует поляризации связи C-Hal, которая облегчается при увеличении количества электронных оболочек.
Реакция ароматического нуклеофильного замещения галогена имеет важное значение в органическом синтезе, т.к. позволяет получать ценные соединения – амины, фенолы и их эфиры, тиофенолы, сложные алкилбензолы, полиарены и многие другие – полупродукты для производства полимеров, красителей и лекарственных препаратов.
Мономолекулярное ароматическое нуклеофильное замещение (SN1Аr)
Арилгалогениды не склонны реагировать по механизму SN1Аr с промежуточным образованием арильного катиона. Единственный пример реакции такого рода – разложение солей арендиазония (см. главу Диазосоединения) под действием жестких анионов или нейтральных молекул (Н2О, ОН-, F-).