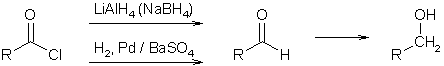
Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот можно рассматривать как соединения, которые могут быть получены из карбоновых кислот и превращены в соответствующие кислоты посредством гидролиза. В функциональную группу производных кислот входит электронодефицитный атом углерода, что является причиной их способности к ацилированию N-, O-, C-нуклеофилов. При этом происходит превращение одних производных карбоновых кислот в другие, а также ацилирование углеродсодержащих групп.
Реакции ацилирования
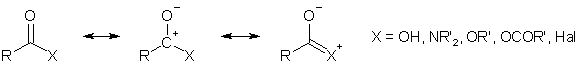
Производные карбоновых кислот можно представить несколькими резонансными структурами

Легко видеть, что положительный заряд на атоме углерода (а, значит, и восприимчивость к нуклеофильной атаке), тем больше, чем слабее мезомерный (+М) и сильнее индуктивный (-I) эффекты заместителя X, называемого уходящей группой или нуклеофугом.
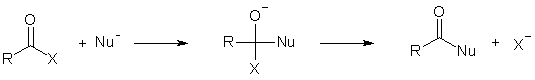
В соответствии с этим, ряд ацилирующей активности производных карбоновых кислот выглядит следующим образом:
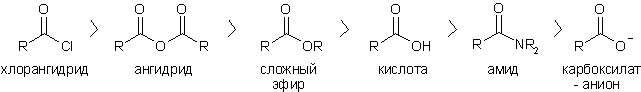
Однако, в определенных условиях (в первую очередь, в присутствии катализаторов), этот порядок может меняться. Рассмотрим свойства определенных производных карбоновых кислот подробнее.
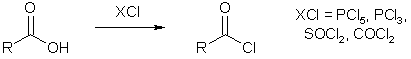
Галогенангидридами называются соединения, образующиеся путем замены гидроксила в молекуле карбоновой кислоты на галоген. Наиболее распространены хлорангидриды кислот, т.к. бром- и иодангидриды более труднодоступны, а фторангидриды неустойчивы. Основной способ синтеза хлорангидридов заключается в обменной реакции с хлорангидридами неорганических кислот.
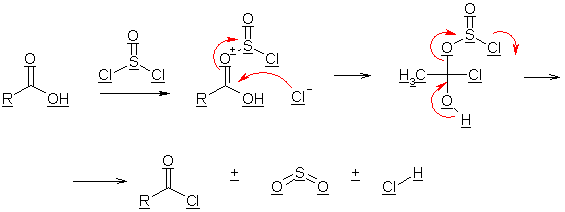
Нуклеофильное замещение гидроксила хлорид-ионом становится возможным благодаря активации карбонильной группы исходной молекулы за счет комплексообразования кислорода с электроположительным атомом реагента. Последний выступает в роли кислоты Льюиса:
Хлорангидриды кислот относятся к сильным электрофилам, они взаимодействуют с широким спектром нуклеофильных реагентов. В результате превращений могут быть получены разнообразные классы соединений, которые относятся к производным карбоновых кислот или карбонильных соединений. Гидролиз хлорангидридов дает соответствующие карбоновые кислоты.
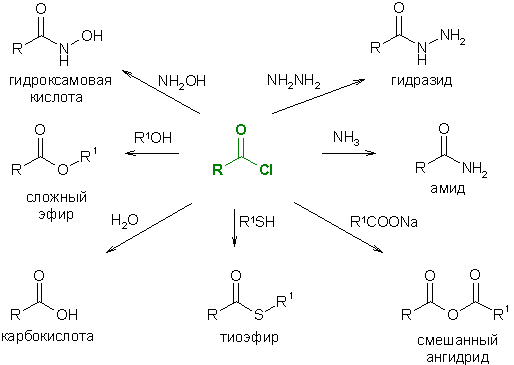
Галогенангидриды аналогичным образом реагируют с жирными и ароматическими аминами, фенолами и тиофенолами, азидом натрия и прочими нуклеофилами, давая соответствующие производные карбоновых кислот.
Взаимодействие ацилгалогенидов с С-нуклеофилами является важным методом путем углеродной цепи. Так, при действии ацилхлорида на диазометан образуется диазокетон
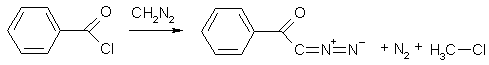
Разложение диазокетона приводит через промежуточное возникновение ацилкарбена к образованию карбоновой кислоты, содержащей на один С-атом больше, чем кислота, хлорангидрид которой вводился в реакцию.
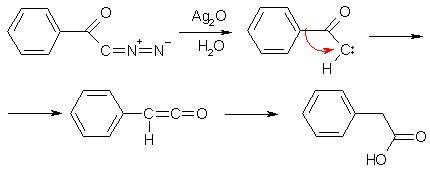
Это превращение (реакция Арндта-Эйстерта) применяется для гомологизации карбоновых кислот.
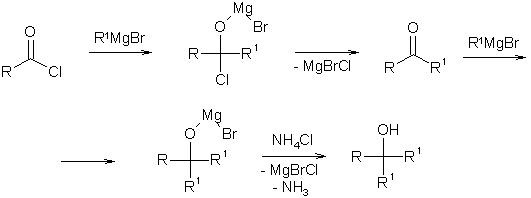
Реакции с такими активными субстратами, как реактивы Гриньяра, протекают энергично и зачастую не останавливаются на стадии кетона, а протекают более глубоко и приводят к образованию спиртов.
Ацилирование аренов и ароматических соединений с низкой нуклеофильностью проводят в присутствии катализаторов кислот Льюиса (реакция Фриделя – Крафтса).
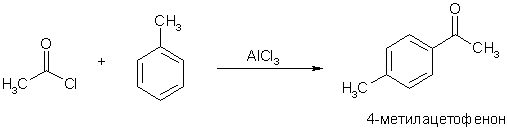
Хлорангидриды – соединения, обладающие большей электронодефицитностью, чем карбоновые кислоты, восстанавливаются более легко. Для их восстановления можно использовать как каталитическое гидрирование, так и действие комплексными гидридами металлов. Последнюю реакцию можно рассматривать как ацилирование гидрид-иона. В зависимости от условий проведения гидрирования, восстановление можно остановить на стадии альдегида либо получить карбинол.