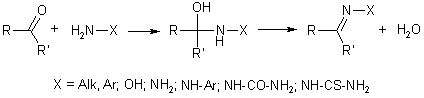
Оксосоединения
Свойства оксосоединений
Реакции присоединения-отщепления
N-нуклеофилы
Как было показано, присоединение нуклеофилов к карбонильной группе не всегда завершается образованием устойчивых продуктов. Поэтому в том случае, когда исходный нуклеофил содержит при реакционном центре два атома водорода, реакция зачастую не останавливается на стадии присоединения и происходит отщепление молекулы воды. Например, так идет реакция, приводящая к иминосоединениям, содержащим двойную связь с атомом азота при бывшем карбонильном атоме углерода. Формально происходит замещение атома кислорода азотистым фрагментом, но в ряде случаев удается выделить промежуточные аддукты – результат присоединения, поэтому реакция не получила титул "замещение". Реакция присоединения-отщепления наблюдается при взаимодействии альдегидов и кетонов с такими аминосоединениями, как первичные амины, гидроксиламин, гидразин, арилгидразины, семикарбазид, тиосемикарбазид.
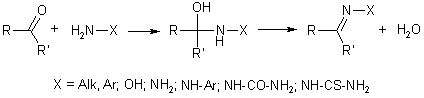
В зависимости от активности реагентов, оксосоединения и азотсодержащего нуклеофила, реакция может идти без катализатора либо в условиях кислого катализа. Роль кислоты, как и в приведенных выше примерах, состоит в активации карбонильной группы, что бывает необходимо, когда применяется слабый нуклеофил, например, ароматический амин.
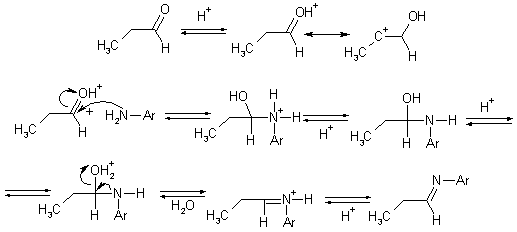
Менее распространенный катализ основаниями заключается в отрыве протона от атома азота в аддукте, после чего следует отщепление гидроксид-иона.
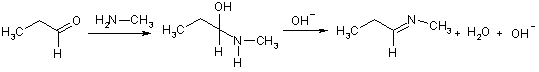
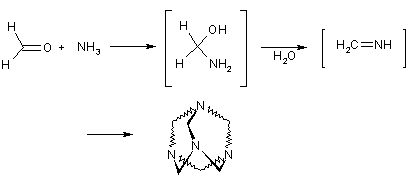
Характер продуктов реакции оксосоединений с аминами зависит от природы реагентов. Формальдегид с аммиаком образует неустойчивый метиленимин, который вступает во вторичные превращения, результатом которых является образование полициклического соединения гексаметилентетрамина (уротропина). Нужно отметить, что этот аддукт состава 6:4 образуется даже в том случае, когда используются другие соотношения реагентов.
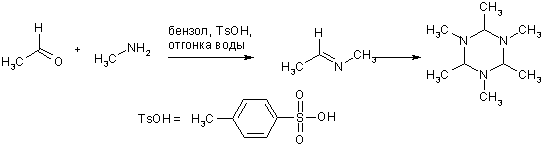
Имины на основе алифатических альдегидов и кетонов и алкиламинов тоже малоустойчивы; они легко гидролизуются до исходных, поэтому реакцию проводят с отделением воды. При хранении такие имины склонны к обратимой тримеризации. Кетоны реагируют медленнее, чем альдегиды.
Ароматические альдегиды образуют более устойчивые имины, особенно если амин – тоже ароматический, в данном случае реакция идет с хорошим выходом без необходимости удаления воды. Это связано с тем, что связь C=N стабилизирована сопряжением с ароматическим(и) ядром(ами). Такие альдимины получили название азометины, а также по имени их первооткрывателя и исследователя – основания Шиффа.
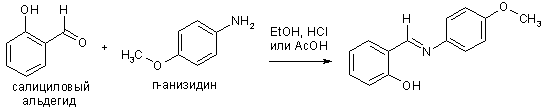
Наконец, наименее активные карбонильные соединения, такие как диарилкетоны в обычных условиях реагируют только с сильнейшими N-нуклеофилами, например, гидразинами.
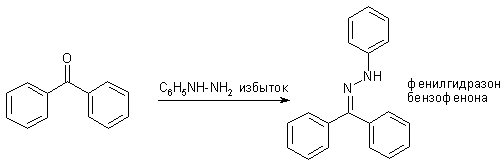
Незамещенный гидразин зачастую реагирует с альдегидами и кетонами своими обеими аминогруппами. Возникающие в результате такой реакции соединения называют азинами.
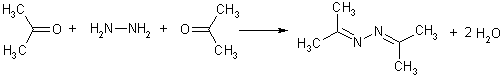
Реакцию только по одной аминогруппе гидразина удается провести в условиях большого избытка последнего. Образующееся соединение называется гидразоном альдегида (кетона).
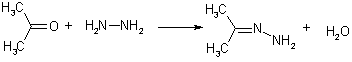
Для идентификации оксосоединений зачастую используют 2,4-динитрофенилгидразин, который в присутствии кислот образует трудно растворимые кристаллические гидразоны. Необходимость катализа в данной реакции обусловлена низкой нуклеофильностью 2,4-ДНФГ.
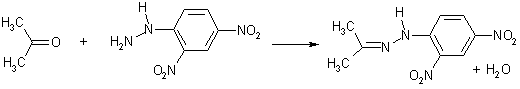
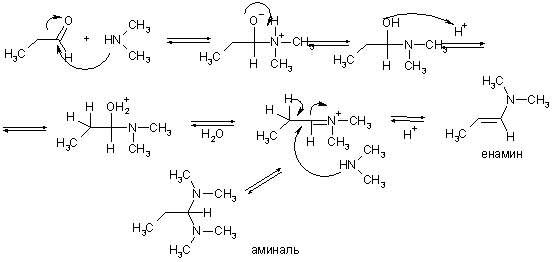
Наконец, реакция альдегидов со вторичными аминами может привести либо к аминалям, либо к енаминам. Второй вариант реализуется в том случае, когда альдегид имеет α-атомы водорода.
Галогены
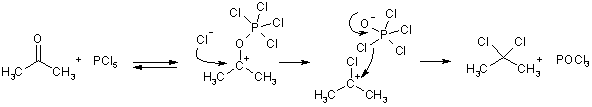
С галогенид-ионами карбонильные соединения реагируют только в активированной форме, превращаясь в гем-дигалогенопроизводные. Подходящими реагентами являются галогениды фосфора. Движущей силой реакции является активация карбонильного соединения за счет образования связи O-P.
С-нуклеофилы
К реакциям присоединения-отщепления относятся альдольно-кротоновая конденсация и родственные ей превращения. Собственно кротоновая конденсация протекает при обработке алифатических альдегидов крепкой щелочью. Основание превращает альдегид в резонансно-стабилизированный енолят-анион вследствие депротонирования a-положения. Анион, как С-нуклеофил, присоединяется к другой молекуле альдегида с образованием альдегидо-спирта (альдоль), который затем отщепляет воду и превращается в кротоновый альдегид.
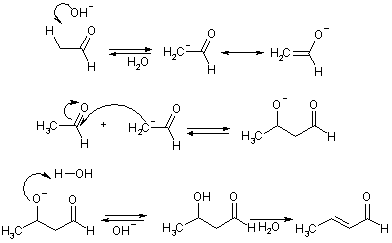
Таким образом, альдольная конденсация представляет собой первую стадию альдольно-кротоновой. В зависимости от условий, могут быть получены оба этих продукта. Конденсация идет также в кислой среде, но в этих условиях обычно удается получить только непредельное соединение.
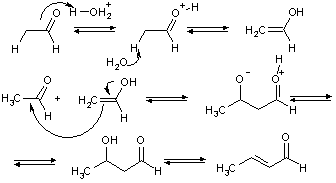
Отметим, что все стадии превращения являются обратимыми, причем для алифатических альдегидов и кетонов равновесие самоконденсации сильно смещено влево.
Альдольно-кротоновая конденсация может быть перекрестной, когда используется смесь различных карбонильных соединений. Если реагенты имеют родственную природу, например, два алифатических кетона, имеющих a-водороды, образуется сложная смесь всех возможных продуктов. Однако, соединения разных классов обычно конденсируются вполне определенным образом. Так, кетон в реакции с альдегидом всегда выступает в качестве СН-кислотной компоненты.
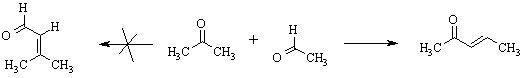
Особенно часто в перекрестную реакцию вводят ароматические альдегиды, которые a-водородных атомов не имеют и поэтому всегда реагируют как электрофилы.
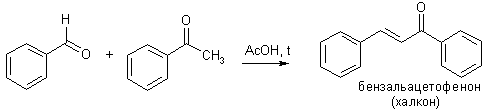
По аналогичному кротоновой конденсации механизму идут реакции Перкина, Кневенагеля, Виттига.
Реакция Кневенагеля – взаимодействие альдегидов в щелочной среде с соединениями, проявляющими повышенную СН-кислотность. К ним относятся β-дикарбонильные соединения, нитроалканы, малоновая кислота и ее производные, и т.д.
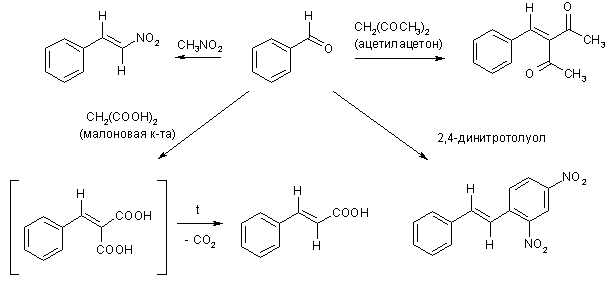
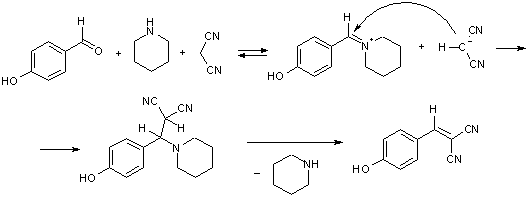
Реакция наиболее эффективно катализируется вторичными алифатическими аминами, которые с одной стороны, депротонируют СН-кислоту, а, с другой стороны, активируют альдегид, превращая его в более электрофильную соль иммония.
В том случае, когда в качестве СН-кислотной компоненты используется ангидрид алифатической кислоты, превращение называют реакцией Перкина.
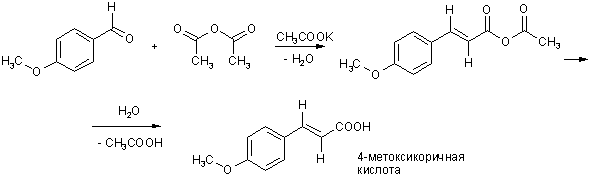
Катализатором реакции служит соль той же алифатической кислоты, ангидрид которой используется.
Реакция Виттига представляет собой присоединение-отщепление к альдегиду или кетону илида фосфора. Илидами называются соединения, имеющие связь С-гетероатом и разделенные заряды: минус на углероде, плюс – на гетероатоме. В данном случае реагент синтезируют на основе трифенилфосина: сначала получают четвертичную соль фосфония, затем обрабатывают ее основанием.
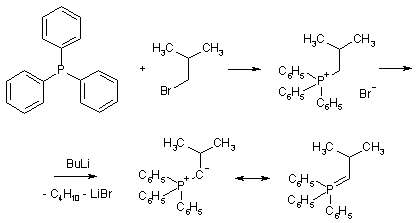
Реакция сопровождается образованием окиси трифенилфосфина и протекает, предположительно, через четырехцентровое переходное состояние.
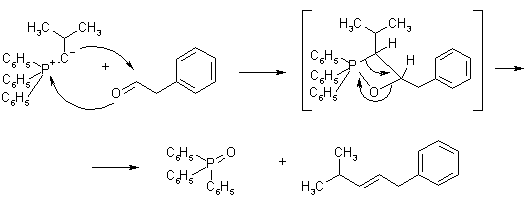
Благодаря универсальному характеру и возможности широко варьировать структуру исходных соединений, реакция Виттига является важным общим методом синтеза непредельных соединений.
Простейшей реакцией, демонстрирующей повышенная подвижность a-атомов водорода, является реакция дейтерообмена, которая идет как в кислой, так и в щелочной среде.
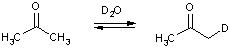
В зависимости от количества дейтерирующего реагента могут быть заменены все α-атомы водорода.
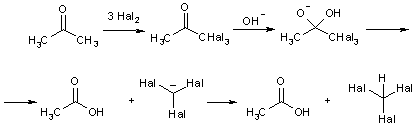
Альдегиды и кетоны способны участвовать в других реакциях замещения по α-положению. Так, они легко галогенируются действием молекулярных галогенов, например, ацетофеноны легко бромируются в уксуснокислом растворе.
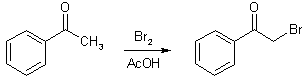
Реакция может протекать по механизму присоединения-отцепления к енольной форме оксосоединения или енолят-аниона (в присутствии оснований), либо как свободнорадикальный процесс.
В щелочной среде при действии избытка галогена реакция зачастую (но не всегда) не останавливается на стадии монозамещения и идет дальше, причем обычно галогенируется все тот же атом. Это объясняют тем, что при появлении электроотрицательного галогена СН-кислотность возрастает. Процесс заканчивается гидролитическим разрывом С-С-связи, и превращение называют галоформным расщеплением, т.к. образуется тригалогенметан – галоформ.
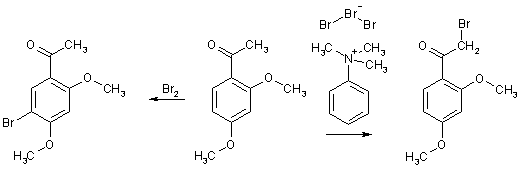
Свободнорадикальное галогенирование α-положения проводится в малополярных растворителях (CHCl3, CCl4) и катализируется такими реагентами, как перекись бензоила. В некоторых случаях приходится применять специфические бромирующие реагенты, например, пербромид триметилфениламмония (PTT) избирательно реагирует с СН3-группами даже при наличии сильно электроноизбыточных заместителей в ядре. Данный реагент, например, представляется единственно эффективным для получения 2,4-диметоксифенацилбромида.
Разумеется, одной из важнейших реакций α-метиленового звена альдегидов и кетонов является альдольная и альдольно-кротоновая конденсация, рассмотренные нами выше.